间充质干细胞在药物输送、肿瘤治疗、免疫调节、组织再生等领域的研究现状分析
来源: 发布日期:2024-09-04 浏览次数:472次
近日,国内学者在一篇综述中,全面分析了间充质干细胞(MSCs)及其衍生物在药物输送、肿瘤治疗、免疫调节、组织再生等领域研究现状。此外,还探讨了干细胞治疗局限性和临床转化挑战,旨在确定重要发展领域和未来潜在方向。

引 言:近年来,MSCs越来越受到临床关注,其载药和衍生物已被证明可以将药物和治疗性细胞因子递送至损伤部位。据报道,MSCs可用于神经分化、炎症减轻和各种肿瘤模型,如黑色素瘤、结肠癌、胰腺癌、乳腺癌和肝细胞癌等。
嵌合抗原受体(CAR)广泛用于T细胞、自然杀伤细胞、树突状细胞和巨噬细胞,尽管具有疗效,但CAR相关疗法面临着诸如CAR携带细胞持久性差、细胞因子释放综合征和细胞功能障碍等挑战。
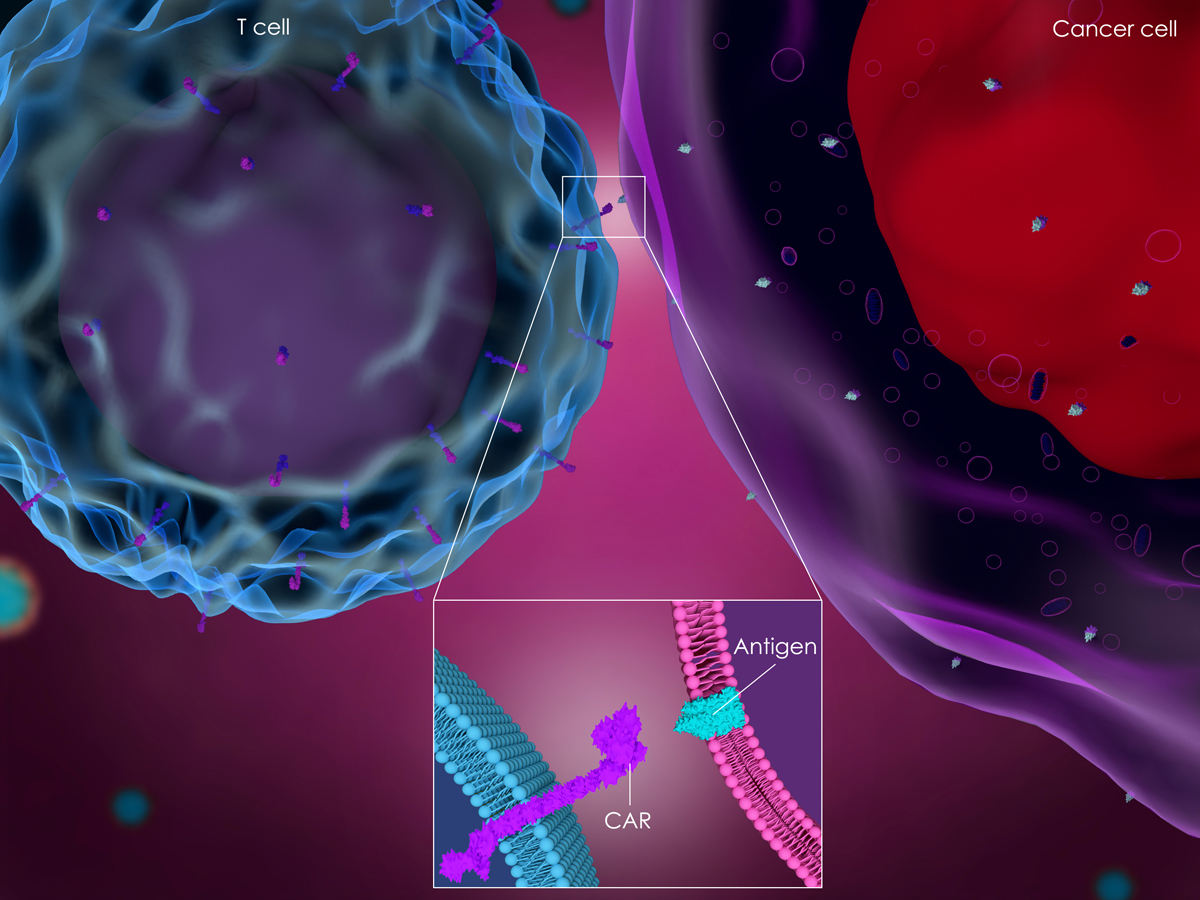
最近的研究表明,MSCs可以增强基于CAR疗法功能,并帮助克服这些缺点,提高细胞疗法整体有效性。Sirpilla团队使用E-钙粘蛋白靶向嵌合抗原受体构建CAR-MSCs,以增强炎症部位的免疫抑制效力,同时保持其干细胞表型和实验的安全性。
Aliperta等使用MSCs作为自主细胞机器,连续生产最人性化的抗CD33-抗CD3 bsAb,使其能够将人类T细胞重定向到表达CD33的白血病细胞,这项研究表明,MSCs修饰的CAR在调节T细胞等其它免疫细胞增殖的同时具有更大杀伤力。
一、MSCs起源和与优势
20世纪70年代,Friedenstein等首先将MSCs鉴定为骨髓中纺锤形、贴壁的非造血干细胞。 根据国际细胞与基因治疗学会(ISCT)资料,流式细胞术检测MSCs时,发现CD105、CD90、CD73的表达率超过95%,CD45、CD34的表达率低于5%,同时满足塑料粘附的标准培养条件,且具有向成骨细胞、脂肪细胞和成软骨细胞分化的潜力,则可认为所获得的样品为MSCs。
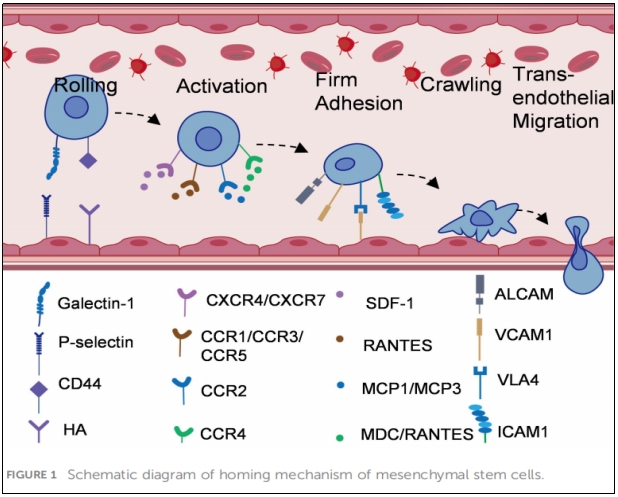
MSCs疗法关键优势是它能够优先归巢到受损组织,这一特性在组织再生中非常重要,这反映了干细胞和祖细胞募集和归巢到需要修复的受损组织能力。与白细胞迁移到炎症部位的过程不同,MSCs归巢分为非系统性归巢和系统性归巢。非系统归巢是指MSCs局部移植到受损部位,而系统归巢是指MSCs在受损组织释放的归巢促进因子的引导下,通过血管内皮细胞迁移到靶组织(图1)。
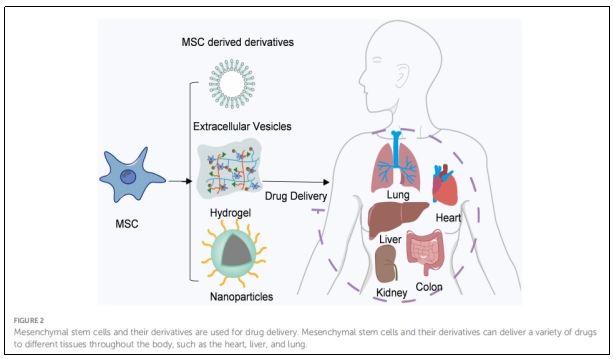
二、MSCs作为药物递送载体
目前MSCs疗法已成为抗肿瘤治疗和组织再生的一个突出领域,它的临床应用潜力已扩展到全身性疾病,如移植物抗宿主病(GVHD)、红斑狼疮、心肌梗塞、中风、自闭症、多发性硬化症、肝硬化、糖尿病、肺损伤和癌症等(图2)。
1.肿瘤治疗:癌症是世界范围内一个主要公共卫生问题,严重威胁着人类健康,大量研究一致表明MSCs参与癌症的发生、发展、进展和转移。此外,研究证实了MSCs免疫调节特性及其选择性迁移到炎症和肿瘤部位的能力,使其成为靶向递送抗肿瘤治疗有前途的载体。
作为抗肿瘤药物载体,MSCs可以进行基因工程改造,以表达或分泌多种抑制癌症生长和进展的治疗剂,这些药物包括治疗性蛋白质、自杀基因和溶瘤病毒,细胞因子和生长因子已被确定为肿瘤发展中的关键调节因子,因此,基于细胞因子和生长因子的治疗性蛋白质阻碍肿瘤生长或作为促肿瘤因子的抑制剂已成为潜在的抗肿瘤药物。
此外,MSCs还被设计为分泌自杀基因,将无毒试剂转化为有毒抗肿瘤药物,通过基因导向的酶前药疗法,可以利用细菌和酵母胞嘧啶脱氨酶(CD)的酶活性将毒性较小的底物5-氟胞嘧啶(5-FC)转化为5-FU,来规避5-FU的全身毒性。
2.免疫调节:迄今为止,MSCs已通过直接细胞间接触和可溶性因子的旁分泌表现出免疫调节作用,包括调节淋巴细胞增殖、抑制树突状细胞活化、调节B细胞增殖和功能、诱导调节性T细胞增殖和抑制自然杀伤细胞活化。
在体外,MSCs已被证明可以通过上调细胞间粘附分子-1(ICAM-1)和血管细胞粘附分子-1 (VCAM-1)来抑制幼稚和记忆T细胞与抗原呈递细胞的通讯,ICAM-1是T细胞活化和白细胞募集到炎症部位的关键。此外,表达Toll样受体3和Toll样受体4的MSCs也已被证明在感染存在的情况下可以恢复有效的T细胞反应。
多项研究发现,用缺氧和免疫调节因子预处理的MSCs,可以通过增加旁分泌效应和抗氧化活性以及在急性肾损伤和博来霉素诱导的肺纤维化中观察到血管生成因子分泌来增加其生存潜力和疗效。
3.纤维化疾病:器官纤维化的原因之一是成纤维细胞的可塑性,研究表明,脂肪细胞和脂肪样细胞在肺、肝和皮肤纤维化的发展过程中转化为分泌胶原蛋白的肌成纤维细胞,肌成纤维细胞是参与纤维化的原代细胞,它们的激活可由多种机制触发,包括来自巨噬细胞和淋巴细胞的旁分泌信号或来自肌成纤维细胞本身的自分泌信号。
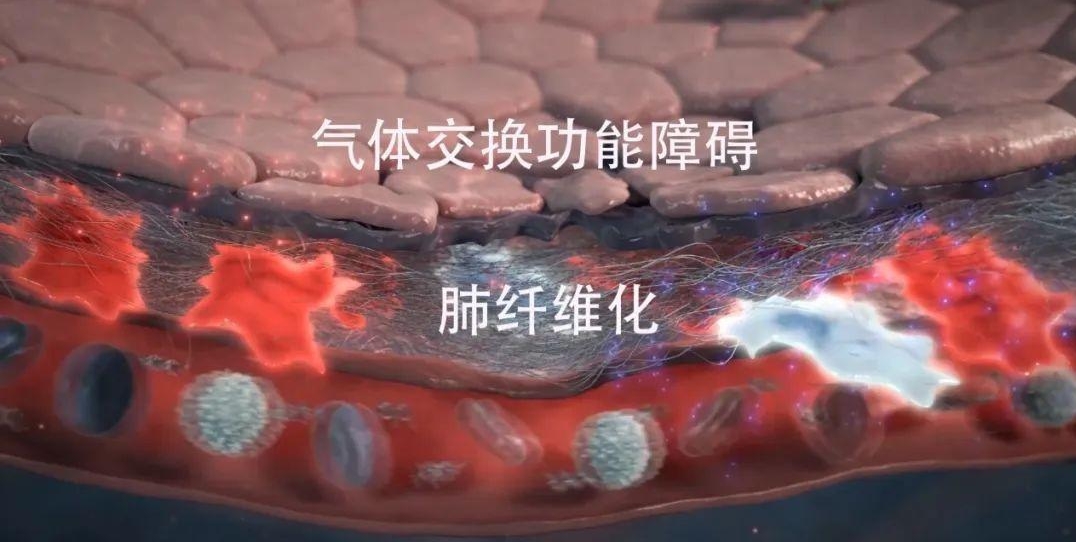
Schermulty等在纤维化发展过程中,发现形成的基因工程肌成纤维细胞在肺中再生成脂肪样细胞和脂肪细胞。鉴于MSCs的多向分化潜力,研究MSCs衍生的肌成纤维细胞可能为未来抗纤维化疾病治疗提供有价值的提示。
三、MSCs衍生物作为药物递送载体
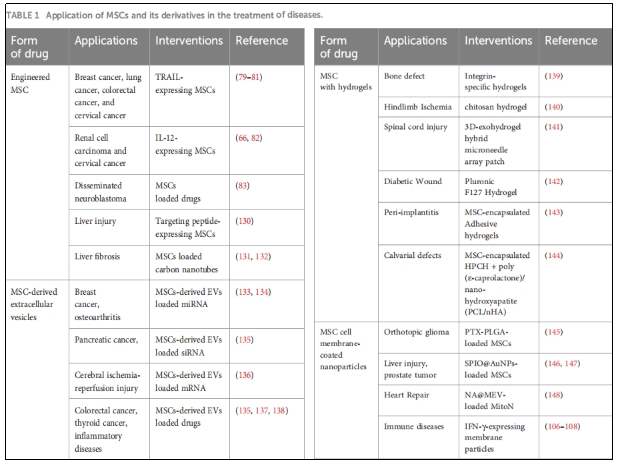
载药和基因修饰的MSCs可以将药物和治疗性细胞因子输送到损伤或炎症部位,因此可用于再生和抗肿瘤治疗。从细胞衍生的肽修饰到基于细胞的药物递送系统,基因工程和仿生学提供了一种纳米颗粒的新策略,是药物治疗的有吸引力的候选者。在这里,我们总结了一些关于MSCs及其衍生物在疾病治疗中的应用研究(表1)。
四、MSCs临床转化挑战
MSCs作为一种细胞疗法应用最为广泛,与其它细胞疗法不同,MSCs的治疗效果不仅依赖于细胞与细胞的接触,而且可能存在打了就跑的机制。细胞与细胞之间的接触是通过与相邻或附近细胞形成间隙连接或隧道纳米管来实现,从而允许小分子、肽和细胞器的转移。
Bahr等检查了18名接受人类白细胞抗原不匹配的MSCs移植患者尸检材料,发现长期移植的MSCs似乎只有非常低的水平,这可能是由于接受者免疫系统的排斥,或静脉移植后无法存活。因此,他们提出,MSCs似乎是通过“肇事逃逸”机制来调节其功能,而不是通过持续植入受损组织。

虽然MSCs通过短暂的“打了就跑”机制发挥治疗功能,但保护MSCs免受免疫检测并延长其在体内的持续时间可能会改善临床结果并防止患者对供体抗原过敏。因此,MSCs以旁分泌方式分泌可溶性细胞因子、生长因子、激素和miRNA。
截至目前,全球已有数十种MSCs疗法获得批准,Alofisel是欧盟批准的第一个同种异体干细胞疗法。尽管一些MSCs疗法取得了成功,但仍然存在一些因素可能导致临床结果不理想,例如MSCs产品质量、管理和宿主等因素。
研究表明,冷冻保存的MSCs抑制免疫抑制和T细胞增殖的能力下降。据Hofmann等报道,在局部施用MSCs治疗几个小时后,只有不到5%的注射细胞保留在注射部位。因此,为了提高治疗效果,应进一步加强MSCs的保留和存活。
总 结:在这篇综述中,我们分析了MSCs治疗现状以及临床治疗转化应用面临的挑战,发现各种生物、生化和生物物理因素通过细胞、细胞外基质和体外和体内生物活性因子之间的相互作用均会影响MSCs存活和归巢能力。因此,通过调节上述因素来减少细胞损伤,提高MSCs存活率,增加MSCs归巢能力,提高MSCs植入效率。
对于MSCs大规模临床生产和使用,重要的是规范和优化细胞来源和培养物价格调整,制定更详细和准确的鉴定标准,明确生物学机制,并制定MSCs来源和组合的标准化计划,根据不同类型的疾病来选用生物材料,使MSCs尽快临床转化。
参考资料:
Ruiyan Mei, Zhuo Wan, Cheng Yang, Xiangjing Shen,Ronglin Wang, Haihua Zhang, Rui Yang, Junqiang Li,Yang Song and Haichuan Su.Advances and clinical challenges of mesenchymal stem cell therapy.DOI 10.3389/fimmu.2024.1421854.















